Ein Kurzreport der UK Health Security Agency vom 31. Dezember 2021 beschreibt, welche Erfahrungen man in Großbritannien bisher mit der Omikron-Variante (B.1.1.529) gemacht hat. Bis Ende 2021 wurden insgesamt fast 200.000 Fälle mit dieser Variante durch Sequenzanalysen diagnostiziert und bei 450.000 Menschen wurde die Omikron-Variante als Infektionsursache aufgrund eines „S Gene Traget Failure“ (SGTF) vermutet. Natürlich liegt die Dunkelziffer der Infektionen deutlich höher, da zahlreiche Infektionen asymptomatisch verlaufen und milde Fälle oft nicht als Corona-Infektionen diagnostiziert werden.
Im Vergleich zur Delta-Variante berichtet die UK-HSA ein etwa um die Hälfte vermindertes Risiko für Krankenhausaufnahmen oder Aufsuchen einer Notaufnahme bei ungeimpften Personen, die sich mit der Omikron-Variante infizieren. Das Risiko, auf einer Intensivstation aufgenommen zu werden, ist um etwa 60 Prozent im Vergleich zu Infektionen mit der Delta Variante reduziert. Das mittlere Alter im Krankenhaus aufgenommener Patientinnen und Patienten betrug 45,5 Jahre. 61 Prozent der Erkrankten waren 40 Jahre und älter, 31 Prozent waren 70 Jahre und älter. Die Todesrate bei hospitalisierten Omikron-Fällen lag in ersten Auswertungen bei sechs bis sieben Prozent.
Die Impfung schützt auch bei Infektionen durch die Omikron-Variante vor schweren Verläufen (Spitalsaufenthalt).
Tabelle 1:
| Impfstatus | Risiko Omikron HR; (95% CI) | Risiko Delta HR; (CI) |
| Ungeimpft oder 1. Stich <28 Tagen | 1 (Referenz) | 1 (Referenz) |
| >14 Tage nach dem 2. Stich | 0,35 (0,29-0,43) | 0,18 (0,17-0,19) |
| >14 Tage nach dem 3. Stich | 0,19 (0,15-0,23) | 0,15 (0,13-0,16) |
Eine HR von 0,35 bedeutet ein um 65% vermindertes Risiko, eine HR von 0,19 ein um 81% verringertes Risiko im Vergleich zur Referenzpopulation
Der erworbene Impfschutz gegen eine symptomatische Infektion ist stark zeitabhängig und hängt zudem vom verwendeten Impfstoff ab: Mit Astra-Zeneca geimpfte Personen haben nach der 20. Woche keinen Schutz mehr vor einer symptomatischen Infektion. Bei den Impfstoffen von Pfizer und Moderna sinkt die Effektivität gegen eine symptomatische Infektion nach zwei Impfdosen von 70 Prozent (zirka zwei bis drei Wochen nach der Zweitimpfung) auf 10 Prozent nach 20 Wochen ab. Trotzdem bleibt der Schutz gegen schwere Verläufe mit Krankenhausaufnahme, Intensivstationsaufenthalt oder gar Tod bei allen in Europa gebräuchlichen Impfstoffen deutlich länger bestehen. Selbst ein halbes Jahr nach dem Zweitstich, egal, ob mit einem Vector- oder einem mRNA-Impfstoff geimpft wurde, ist das Risiko eines schweren Verlaufes nur halb so groß wie bei ungeimpften Personen. Nach einer dritten Boosterimpfung sinkt das Risiko schwerer Verläufe sogar um 90 Prozent!
Inaktivierte Virus-Vakzine wie sie etwa in China (z.B. Sinovac) und Indien (z.B. Covaxin von Bharat Biotech) entwickelt wurden, lassen keinen a priori Schutz durch neutralisierende Antikörper gegen die Omikron-Variante entwickeln (Dolgin E. Nature 2022; doi:10.1038/d41586-022-00079-6). Auch eine Booster-Impfung mit dem gleichen Impfstoff führt kaum zu Anstiege der neutralisierenden Antikörper. Trotzdem vermindern auch diese Impfstoffe häufig schwere Verläufe nach erfolgter Immunisierung. Ursächlich wird vor allem die Bedeutung des durch den Impfstoff gepriemten T-Zell Systems diskutiert (Ledford H. Nature 2022; doi:10.1038/d41586-022-00063-0). Trotz zahlreicher neuer Mutationen, vor allem in der Rezeptor-bindenden Domäne der Omikron-Variante, erkennen T-Killerzellen mit Omikron infizierte Wirtszellen und zerstören sie. Das zeigt, nach momentanen Wissenstand, dass die zelluläre Immunität, die durch Impfstoffe oder Infektion induziert wurde, deutlich länger anhält als humorale Immunitätsfaktoren wie z.B. Antikörper, und dass die zelluläre Immunität durch Veränderungen des Virus weniger beeinflusst wird. Im Unterschied zu neutralisierenden Antikörper erkennen z.B. T-Killerzellen sehr viel mehr Virusstrukturen als neutralisierende Antikörper. In-vitro-Studien zeigen, dass T-Zellen, welche aus geimpften Personen oder mit früheren Varianten infizierten Personen gewonnen wurden, durchaus in der Lage waren, mit Omikron infizierte Zellen zu erkennen und zu zerstören (Keeton R et al. medRxiv 2021; doi:10.1101/2021.12.26.21268380; Geurts van Kessel CH. medRxiv 2021;doi:10.1101/2021.12.27.21268416). Eine Untersuchung in 61 Probandinnen und Probanden, die mit mRNA Impfstoffen immunisiert wurden, hat die Immunreaktion der Teilnehmerinnen und Teilnehmer besser charakterisiert (Goell RR et al. Science 2021; 374:abm0829). Die Impfung induziert einen raschen und robusten Anstieg von Antikörpern gegen Anteile des Spikeproteins, insbesondere gegen die Rezeptor-bindende Domäne. Allerdings verschwinden die Antikörper aus dem menschlichen Serum rasch innerhalb der ersten sechs Monate. Was aber bestehen bleibt, ist die Ausbildung dauerhafter B-Gedächtniszellen sowie CD4+ und CD8+ T-Zellen. Die B-Zellen bilden nach Kontakt mit Alpha-, Beta- oder Delta-Virus-Varianten und, unter den stimulierenden Einfluss von CD4+ T-Zellen, sofort neutralisierende Antikörper. CD8+ T-Zellen (Killerzellen) erkennen infizierte Wirtszellen mit Erreger-typischen Antigenen und zerstören sie, wodurch eine Weiterverbreitung des Virus effektiv verhindert wird. Die Persistenz einer B- und T-Zell Immunantwort trotz neuer Variantenbildung des SARS-CoV-2-Virus ist eine sehr positive Nachricht! Die langdauernde zelluläre Immunantwort ist die wahrscheinlichste Ursache für einen langanhaltenden Schutz vor schweren Infektionen nach einer Impfung.
Wie bereits eingangs beschrieben, scheinen Erkrankungen mit der Omikron-Variante in der Regel milder zu verlaufen als mit früheren Virusvarianten. Neue Tierversuche zeigen, dass die Omikron-Variante, verglichen mit frühere Varianten, einen anderen Infektionsweg bevorzugt (Kozlov M. Nature 2022; doi:10.1038/d41586-022-00007-8). In einer früheren Ausgabe des Updates haben wir den Infektionsmodus des Delta-Virus näher beleuchtet: Nach der Bindung der Delta-Variante an den ACE-II-Rezeptor spaltet eine körpereigene, transmembranöse Protease (TMPRSS 2) die S2-Untereinheit des Spikeproteins ab. Die verbleibende S1-Untereinheit verändert sich räumlich derart, dass die Virusmembran an die Wirtszellmembran gezogen wird und mit dieser verschmilzt. Das Virus-Kapsid mit der Virus-RNA entleert sich direkt in die Wirtszelle. Da das Enzym TMPRSS 2 besonders dicht auf Alveolarzellen gefunden wird, infiziert das Delta-Virus, wie auch frühere Varianten, bevorzugt tiefe Lungenabschnitte und führt klinisch häufig zur Pneumonie. Eine weitere Besonderheit ist die Bildung großer verschmolzener Zellverbände bestehend aus Alveozyten in der Lunge (Synzytienbildung). Diese Zellverbände repräsentieren wahrscheinlich große „Virusproduktionsfabriken“ – allerdings ist die wahre pathophysiologische Bedeutung dieser Synzytienbildung bei Viruserkrankungen (z.B. Herpes, RS-Viren) noch nicht endgültig geklärt.
Die Omikron-Variante mit ihren zahlreichen Mutationen in der Rezeptor-bindenden Domäne scheint keine besondere Affinität zum Enzym TMPRSS 2 zu haben. Im Tierversuch zeigen sich nach einigen Tagen deutlich verminderte Omikron-Viruskonzentrationen im Lungengewebe, verglichen mit Infektionen durch frühere Varianten (Diamond M et al. Research Square 2021; doi:10.21203/rs.3.rs-1211792/v1). Auch die strukturellen Lungenschäden sind im Vergleich mit früheren Varianten geringer – die Bildung von Synzytien, wie bei früheren Varianten, in der Lunge fehlt nach derzeitigen Wissensstand. Omikron wird vor allem in den oberen Atemwegen (Nase, Rachen, obere Luftwege) durch Endozytose aufgenommen und das Virus vermehrt sich hier besonders gut (Peacock TP 2022; bioRxiv; doi: 10.1101/2021.12.31.474653; Willett BJ 2022; medRxiv: doi: 110.1101/2022.01.03.21268111). Die Infektion der oberen Atemwege wird auch zur Erklärung der hohen Transmissibilität herangezogen. Prinzipiell ist das geringere Pneumonie Risiko sicher ein großer Vorteil in der aktuellen Pandemiewelle und verringert die Wahrscheinlichkeit, auf einer Intensivstation aufgenommen zu werden. Allerdings besteht in der bevorzugten Infektion der Schleimhäute der oberen Atemwege auch ein Risiko für besonders vulnerable Personengruppen. Gerade bei Babys und kleinen Kindern könnten Infektionen mit der Omikron-Variante schwere Verläufe mit Krupp-artigen Symptomen verursachen. Bis jetzt existieren allerdings noch keine Daten, die einen derartigen Zusammenhang belegen würden.
In einer in-vitro-Studie vergleichen Garcia-Beltran WF et al. (Cell 2021; doi:10.1016/j.cell.2021.12.033) die Virus-Neutralisationsfähigkeit von Plasmaproben von mit Pfizer, Moderna oder Astra-Zeneca Geimpften gegen das Wildtyp-Virus, die Delta- und die Omikron-Variante des SARS-CoV-2-Virus. Die Seren von mit mRNA-Impfstoffen geimpften Personen neutralisierten das Wildtyp-Virus deutlich besser als jenes von mit Ad26.COV2.S Geimpften. Für das Delta-Virus konnte sechs Monate nach Immunisierung keine relevante Neutralisation des Spikeproteins mehr festgestellt werden. Nach zwei Vakzin-Dosen, egal mit welchem Impfstoff, konnten auch keine Neutralisationseffekte gegen die Omikron-Variante festgestellt werden. Allerdings führte eine dritte Impfung mit einem mRNA-Impfstoff zu deutlich gesteigerter Neutralisationsaktivität auch gegen das Spikeprotein der Omikron-Variante. Dies kann einerseits durch die deutlich gestiegenen Antikörpertiter, aber auch durch eine erhöhte Kreuzreaktivität mit verschiedenen Strukturen des Spikeproteins erklärt werden. Somit bestätigt dieses in-vitro-Modell bisherige klinische Erfahrungen, die zeigen, dass eine Boosterimpfung mit mRNA-Impfstoffen über eine deutliche Erhöhung der Plasmaspiegel neutralisierender Antikörper auch das Spikeprotein der Omikron-Variante neutralisieren und so eine symptomatische Infektion verhindern kann. Die Tatsache, dass das Virus effektiv an der Infektion von Wirtszellen gehindert werden kann, vermindert auch das Risiko einer Übertragung auf andere Personen.
Eine Arbeit aus Südafrika beschreibt Unterschiede im klinischen Verlauf der SARS-CoV-2-Erkrankung in den bisherigen vier Wellen der Pandemie (Maslo C et al. JAMA 2021; doi:10.2002/jama.2021.24868). Dabei wurden die Daten einer privaten Versicherungsgesellschaft ausgewertet, die insgesamt 49 Akutkrankenhäuser des Landes betreibt.
Tabelle 1 zeigt die wesentlichen Charakteristika betreffend der behandelten Patientinnen und Patienten in den vier Wellen. Insgesamt waren nur 24 Prozent der aufgenommenen Personen in der vierten Welle geimpft. Der Impfstatus wurde in den früheren Infektionswellen nicht erhoben. Die Wellen werden bestimmten Virus-Varianten zugeordnet. Eine definitive Virus-Sequenzierung ist aber im Krankenhaus nicht erfolgt, sodass eine Bezeichnung nach Varianten lediglich anzeigt, dass dieses Virus in der jeweiligen Welle dominant war!
| Welle 1 „Wildtyp“ | Welle 2 „Beta“ | Welle 3 „Delta“ | Welle 4 „Omi-kron“ | p-Werte | |
| Anzahl der Patientinnen und Patienten mit COVID-19 | 2628 | 3198 | 4400 | 971 | <0,001 |
| Alter (Jahre; MW+SD) | 53+21,57 | 54+21 | 59+24 | 36+32 | <0,001 |
| Patienten mit Komorbidität | 56% | 58,4% | 52,5% | 23,3% | <0,001 |
| Sauerstofftherapie | 80,3% | 82% | 74% | 17,6% | <0,001 |
| Mechanische Beatmung | 16,4% | 8% | 12,4% | 1,6% | <0,001 |
| Intensivstation | 42% | 36,6% | 29,9% | 18,5% | <0,001 |
| Krankenhausaufenthaltsdauer (Tage) | 9 | 8 | 9 | 3 | <0,001 |
| Todesfälle | 19,7% | 25,5% | 29,1% | 2,7% | <0,001 |
Die Daten zeigen eindeutig einen wesentlich milderen Verlauf bei Infektionen, die vorwiegend auf die Omikron-Variante zurückzuführen sind. Die behandelten Patientinnen und Patienten waren in der vierten Welle jünger, hatten weniger Vorerkrankungen, benötigten weniger respiratorische Therapieformen und Intensivstationsaufenthalte und hatten eine signifikant reduzierte Krankenhausmortalität. Alle diese Faktoren deuten auf einen milderen Erkrankungsverlauf durch Omikron hin. Bei der Interpretation der Resultate ist allerdings eine gewisse Vorsicht geboten: Die Durchseuchungsrate der südafrikanischen Bevölkerung durch frühere Pandemiewellen dürfte extrem hoch sein und ein Großteil der Bevölkerung hat bereits eine gewisse Grundimmunität ausgebildet – dies mag zu den milderen Verläufen beitragen. Die Bevölkerung in Südafrika ist insgesamt deutlich jünger, verglichen mit dem europäischen oder amerikanischen Durchschnitt. Möglicherweise trägt das zur relativ niedrigen Mortalität und der geringen Krankenhausaufenthaltsdauer in der Studie bei. Zusätzlich handelt es sich um private Krankenanstalten, was auf ein bereits selektioniertes Krankengut (bessere Ernährung und Hygiene, geringere HIV-Belastung) schließen lässt. Die Ergebnisse sind trotzdem auch für uns sehr interessant und lassen sich gut mit den bisherigen Erkenntnissen aus anderen Ländern, z.B. Großbritannien (siehe oben) in Einklang bringen.
In einer randomisierten, offenen Studie (Ospina-Tascon GA et al. JAMA 2021; 326:2161-2171) wurde der Effekt einer Lowflow (LF)- und einer Highflow (HF)-Sauerstofftherapie auf die Progression des durch eine COVID-19-Pneumonie induzierten Lungenversagens mit Notwendigkeit einer mechanischen Beatmung untersucht. Insgesamt wurden 111 Patientinnen und Patienten einer konventionellen Sauerstofftherapie und 109 einer HF-Therapie unterzogen. Das mediane Alter der Patientinnen und Patienten lag bei 60 Jahren. Die häufigsten Vorerkrankungen waren Leberzirrhosen Child-Pugh A-B (HF 35 Prozent und LF 44 Prozent) sowie arterielle Hypertension (HF 35 Prozent und LF 44 Prozent). Die Zeit zwischen Symptombeginn und Randomisierung lag in der LF-Gruppe bei zehn, in der HF-Gruppe bei acht Tagen. 34,4 Prozent der Personen in der HF-Gruppe und 51 Prozent in der LF-Gruppe wurden bis zum 14. Tag nach Randomisierung intubiert. Der Intensivstationsaufenthalt war in der HF-Gruppe um durchschnittlich drei Tage kürzer (sieben versus neun Tage). Der Spitalsaufenthalt war durchschnittlich um zwei Tage verkürzt (12 vs. 14 Tage). Die 28-Tage-Mortalität lag in der HF-Gruppe bei 8 Prozent, in der LF-Gruppe bei 16 Prozent. Mein persönliches Problem mit dieser Studie ist vor allem die ungleiche Verteilung der Vorerkrankungen (Leberzirrhose) und auch der hohe Anteil von Zirrhose-Patientinnen und –Patienten in beiden Gruppen. Der höhere Anteil an Zirrhose-Patientinnen und -Patienten in der LF-Gruppe kann durchaus das Ergebnis massiv beeinflusst haben. Trotzdem ist die Aussage der Studie klar: Ein Therapieversuch mit HFO kann bei Personen mit COVID-19-Pneumonie eine Intubation verhindern und war in dieser Studie mit reduzierter Mortalität und reduziertem Krankenhausaufenthalt verknüpft.
Eine hochinteressante Untersuchung wurde gerade in JAMA Surgery publiziert (Aminian A et al. JAMA Surg 2021; doi:10.100./jamasurg.2021.6496). Adipositas ist mittlerweile als signifikanter Risikofaktor für den Erwerb einer schweren COVID-19-Erkrankung etabliert. Was bisher unklar war ist die Frage, ob eine durch metabolische Chirurgie verursachte Gewichtsabnahme (Magenbypass oder Gastric Sleeve Chirurgie) das Risiko für eine schwere COVID-19-Erkrankungen reduzieren kann.
In dieser Datenbank-Analyse (20.000 Personen mit BMI > 35kg/m2) wurden über einen Zeitraum von sechs Jahren Menschen mit einem Gewichtsverlust von > 19 Prozent nach einem operativen Eingriff identifiziert. SARS-Cov-2-positive Patientinnen und Patienten (PCR) nach Adipositaschirurgie (zirka 9 Prozent aller Patientinnen und Patienten) wurden mit SARS-CoV-2-positiven Personen (PCR) ohne chirurgischen Eingriff (ebenfalls 9 Prozent des Kollektivs) verglichen. Nach Gewichtsabnahme durch den chirurgischen Eingriff war das Risiko einer Hospitalisierung durch eine COVID-19-Erkrankung um die Hälfte reduziert. Das Risiko einer schweren COVID-19-Erkrankung war um 60 Prozent reduziert. Wie schon aus früheren Studien bekannt war das Sterberisiko („all-cause mortality“) operierter Patientinnen und Patienten im Beobachtungszeitraum um insgesamt 55 Prozent niederer als in der nicht operierten, gematchten Vergleichspopulation.
Ende Dezember 2021 hat die FDA zwei neue Virostatika zur Behandlung von milden bis moderaten COVID-19-Erkrankungen zugelassen: Nirmatrelvir (Paxlovid; Pfizer) ist ein viraler Proteaseninhibitor der in vitro virostatische Eigenschaften gegen alle bisherigen SARS-CoV-2-Varianten zeigt. Ritonavir, ein Hemmer des hepatischen Enzyms Cytochrome P3A, verlängert dabei die Wirkdauer von Nirmatrelvir. Nirmatrelvir hemmt die für die Vermehrung des SARS-CoV-2-Virus wichtige Protease 3CL. Viren lassen gerne ihre Proteine „im Stück“ produzieren. Proteasen spalten im Anschluss die Aminosäureketten an den „richtigen Stellen“, sodass innerhalb eines Produktionsschritts gleich mehrere Struktur- oder Funktionsproteine gebildet werden können. In bisherigen Studien vermindert die frühzeitige Gabe von Paxlovid in den ersten drei bis sieben Tagen nach Symptombeginn das Risiko eines schweren Verlaufs mit Krankenhausaufnahme um zirka 90 Prozent. Initial werden zwei Tabletten zu 150mg und eine Tablette mit 100mg Paxlovid oral am ersten Therapietag eingenommen. Die Therapie wird anschließend mit je zwei Tabletten zu 100mg pro Tag oral für fünf Tage fortgeführt. An bisherigen unspezifischen Nebenwirkungen wurden Durchfall, beeinträchtigter Geschmackssinn, Bluthochdruck und Muskelschmerzen berichtet. Paxlovid ist ab 12 Jahren zugelassen und sollte derzeit vor allem im Bereich der Risikogruppen angewandt werden. Einschränkungen der Nierenfunktion benötigen eine Dosisreduktion. Patientinnen und Patienten mit schweren Leber- und/oder Nierenerkrankungen sollten das Medikament nicht erhalten. Bisher wurden keine schwersten, eventuell lebensbedrohlichen, Nebenwirkungen nach der Einnahme des Medikaments berichtet.
Molnupiravir (Lagevrio; Merck) ist ein Nucleosid-Analogon, das zu Mutationen am SARS-CoV-2-Virus führt, die letztlich seine Vermehrungsfähigkeit und Infektiosität beeinträchtigen – „das Virus mutiert sich selbst zu Tode“. Auch Molnupiravir zeigt virostatische Eigenschaften gegen alle bisherigen SARS-CoV-2-Varianten. In einer Untersuchung bei nicht geimpften, SARS-CoV-2-positiv getesteten Personen mit milden bis moderaten Symptomen reduziert die Einnahme von Molnupiravir das Risiko einer Krankenhausaufnahme oder eines tödlichen Erkrankungsverlaufs bis zum 29. Tag um 31 Prozent – vorausgesetzt, die Therapie wird rechtzeitig, am besten innerhalb von 72 Stunden nach Symptombeginn, begonnen (Bernal AJ et al. N.Eng J Med 2021; doi:10.1053/NEJMoa2116044). Molnupiravir wird in Tablettenform – 800mg (4 Tabletten) in jeweils 2 Dosen pro Tag für 5 Tage – verabreicht. Schwindel, Übelkeit, eine milde Anämie und Durchfälle waren die häufigsten Nebenwirkungen, die auf die Einnahme des Virostatikums zurückgeführt wurden. Auch in dieser Studie wurden keine schweren Nebenwirkungen nach Medikamenteneinnahme berichtet. Dennoch besteht die Möglichkeit von Mutationen im wirtseigenem Genom. Wegen möglicher Langzeittoxizität, vor allem für Knochen und Knorpelgewebe, ist Molnupiravir nicht für Schwangere und Jugendliche unter 18 Jahren zugelassen. Das FDA Advisory Board hat bei der Notfallszulassung auch darauf hingewiesen, dass der Einsatz von Molnupiravir das zumindest theoretische Potential hat, neue gefährlichere Virus-Varianten hervorzubringen (U.S. Food and Drug Administration www.fda.gov/media/155050/download; www.fda.gov/media/155054/download).
Sowohl Molnupravir als auch Nirmatrelvir haben den großen Vorteil, dass sie oral und deshalb auch ambulant verabreicht werden können. Beide Virostatika sind derzeit für die Behandlung von Risikopersonen zugelassen. Das sind vor allem ältere ungeimpfte Personen, Patientinnen und Patienten mit schweren Vorerkrankungen, aber auch Erwachsene aller Altersgruppen unter immunsuppressiver Therapie oder aktiver onkologischer Therapie. Im Einzelfall entscheiden Epidemieärztinnen und -ärzte sowie Fachärztinnen und-ärzte für onkologische oder immunologische Erkrankungen über den gezielten Einsatz dieser Substanzen.
Auch Redemsivir, das bereits mehrfach in früheren Updates besprochene Virostatikum, hat – frühzeitig eingesetzt – das Potential, schwere Krankheitsverläufe zu verhindern. In einer vom Hersteller gesponserten Untersuchung wurde Redemsivir ungeimpften Patientinnen und Pateinten mit einem oder mehreren Risikofaktoren für einen schweren Erkrankungsverlauf und einem COVID-19-Symptombeginn vor sieben Tagen oder weniger intravenös verabreicht (200mg am Tag 1; 100mg am Tag 2 und 3). Eine Kontrollgruppe wurde mit Placebo behandelt (Gottlieb R. NEJM 2021; doi:10.1056/NEJMoa2116846). Die Anzahl der Krankenhausaufnahmen war nach frühzeitiger Gabe von Redemsivir um 87 Prozent niedriger (2 von 79) verglichen mit Placebo-Gabe (15 von 283). Interessanterweise fanden sich aber keine Unterschiede zwischen den Gruppen bezüglich der zeitlichen Virusausscheidung über die Nasenschleimhäute. Der Nachteil von Redemsivir im Vergleich zu Molnupiravir und Nirmatrelvir liegt in der Applikationsform, die letztlich eine Verabreichung nur in Ambulanzen zulässt.
Über die globale Bedeutung der COVID-19-Pandemie ist in Nature (Nature 2022; 601:312-315) ein exzellenter Leitartikel von David Adam veröffentlicht worden, den ich hier kurz zusammenfasse. Mit 1. November 2021 wurde offiziell die weltweite Anzahl von Sterbefällen durch das SARS-CoV-2-Virus mit zirka fünf Millionen COVID-19-Toten angegeben. Das Problem bei dieser Angabe ist, dass mehr als 100 Staaten über keine verlässliche Datenerhebung verfügen und dass natürlich die Diagnosemöglichkeiten für COVID-19 in vielen Staaten nur marginal existieren. Als weiteres Problem zeigen sich unterschiedliche Zählweisen von COVID-19-Todesfällen selbst in weit entwickelten Staaten. So wurden z.B. in den Niederlanden anfänglich nur jene Todesfälle als COVID-19-Todesfälle erfasst, die im Krankenhaus mit einem positiven PCR-Test verstorben sind. In Belgien hingegen wurde anfänglich jeder Mensch, der mit respiratorischen Symptomen mit und ohne weiterführende Diagnostik verstorben ist, als COVID-19-Todesfall gezählt. Russland gibt offiziell nur etwa 300.000 Todesfälle bis Ende 2021 bekannt. Die tatsächliche Anzahl der Todesfälle dürfte drei- bis viermal höher sein. Ähnliches wird für Staaten wie Indien und China vermutet. Ich kann in diesem Zusammenhang nur auf die anfänglich „trickreichen“ Zählweisen österreichischer Bundesländer und Krankenanstalten in Bezug auf aktive COVID-19-Fälle verweisen. Das Institute für „Health Metrics and Evaluation“ in Washington und ein „lernender Maschinenalgorithmus“ der renommierten Zeitschrift „The Economist“ versuchen, die Schwächen offizieller Angaben durch Algorithmen und Modellierungen auszugleichen und so ein möglichst realistisches Bild der globalen Auswirkungen der COVID-19-Pandemie zu bekommen. Ihren Berechnungen zufolge beträgt die Todesrate durch COVID-19-Erkrankungen weltweit zwischen 12 und 22 Millionen, also das zwei- bis vierfache der offiziellen Angaben (Abbildung 1).
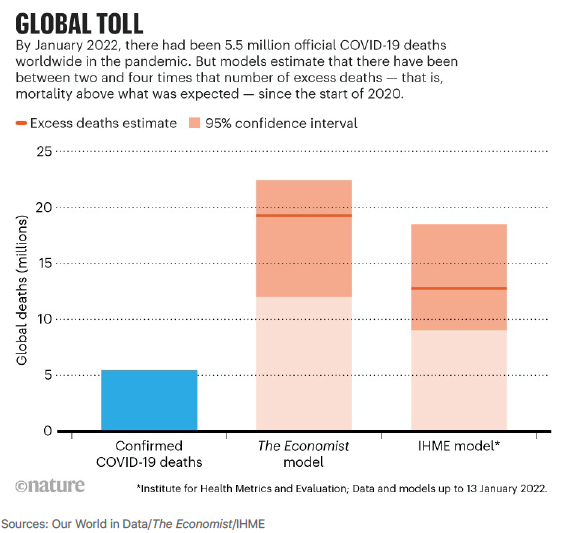
Natürlich beinhalten Modellrechnungen und Modellierungen zahlreiche Unsicherheitsfaktoren. Andererseits unterstützen mittlerweile Untersuchungen über die Auswirkungen auf z.B. die Lebenserwartung von Menschen innerhalb eines Staates die Annahme einer deutlich höheren „Zeche an Leben“, die wir durch COVID-19 verloren haben! Ein US-Bericht über den Einfluss von COVID-19 auf die Lebenserwartung der US-amerikanischen Bevölkerung berechnet, dass die mittlere Lebenserwartung in den beiden Pandemiejahren um zirka 2,1 Jahre für Männer und um 1,5 Jahre für Frauen gefallen ist. (Stephenson J. JAMA Health Forum 2022;3: e215286). Zum Vergleich – in österreichischen Medien wurde vor kurzem eine durchschnittliche Abnahme der Lebenserwartung um 0,5 Jahren berichtet. COVID-19 ist in den USA mittlerweile die dritthäufigste Todesursache in der Statistik nach kardiovaskulären und onkologisch bedingten Todesfällen. Ein Vergleich der COVID-19 Pandemie mit früheren Pandemien zeigt, dass COVID-19 nach der Grippepandemie von 1918, die schwerste Pandemie der letzten 120 Jahre war:
| COVID-19 | Grippewelle 2009 (H1N1) | Grippewelle 1968 (H3N2) | Grippewelle 1957-1959 (H2N2) | Grippewelle 1918 bis 1920 (H1N1) | |
| Exzess Mortalität | 0,15%-0,28% | 0,005% | 0,03% | 0,04% | 1% |
| Globale Sterbefälle (absolut) | 12-22 Millionen | 0,4 Millionen | 2,2 Millionen | 3,1 Millionen | 75 Millionen |
| Mittleres Patientenalter (Jahre) | 73-79 | 37 | 62-65 | 27 |
Quelle: Simonsen L & Viboud C eLife 10: e71974 (2021)
